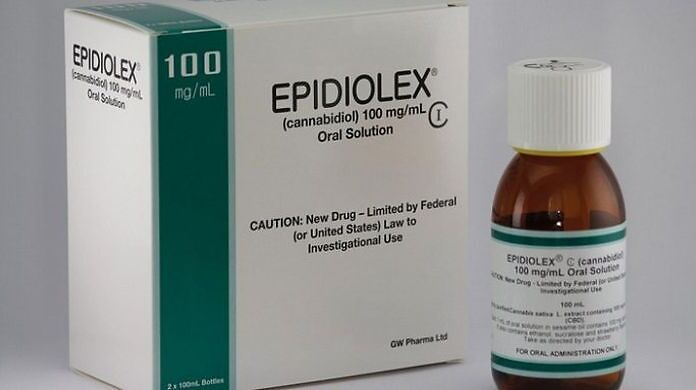
La Food and Drug Administration (FDA) degli Stati Uniti ha approvato l'impiego di cannabidiolo (CBD) in soluzione orale per il trattamento delle crisi epilettiche associate alla sindrome di Lennox-Gastaut (LGS) o alla sindrome di Dravet (DS). Il medicinale si chiama Epidiolex, si propone come il primo di una nuova categoria di agenti antiepilettici ed è la prima formulazione farmaceutica a base di cannabidiolo di origine vegetale ad essere approvata negli USA.
La Food and Drug Administration (FDA) degli Stati Uniti ha approvato l'impiego di cannabidiolo (CBD) in soluzione orale per il trattamento delle crisi epilettiche associate alla sindrome di Lennox-Gastaut (LGS) o alla sindrome di Dravet (DS). Il medicinale si chiama Epidiolex, si propone come il primo di una nuova categoria di agenti antiepilettici ed è la prima formulazione farmaceutica a base di cannabidiolo di origine vegetale ad essere approvata negli USA.
"Le sindromi di Lennox-Gastaut e di Dravet rappresentano due forme di epilessia ad esordio infantile tra le più gravi e difficili da trattare. I piccoli pazienti, insieme alle loro famiglie, si trovano a dover affrontare un percorso terapeutico lungo e impegnativo, e solo pochi di loro riescono ad ottenere un adeguato controllo delle crisi epilettiche", spiega la professoressa Elizabeth Thiele, della Harvard Medical School, uno dei principali ricercatori coinvolti nel programma di sviluppo clinico di Epidiolex. "In base ai risultati di numerosi studi clinici, il cannabidiolo può aiutare a soddisfare le necessità mediche di questa specifica popolazione di pazienti pediatrici, e oggi rappresenta il primo trattamento approvato dalla FDA per la sindrome di Dravet".
Epidiolex è un farmaco antiepilettico a base di cannabidiolo (CBD), il principale cannabinoide non-psicoattivo della Cannabis. L'approvazione della FDA si basa sui risultati di 3 studi clinici di Fase III, randomizzati e controllati, e di uno studio di estensione in aperto. Gli studi di Fase III, pubblicati sulle riviste The New England Journal of Medicine e The Lancet, hanno dimostrato che il CBD, in aggiunta ad altre terapie antiepilettiche, è in grado di ridurre significativamente la frequenza delle crisi in pazienti affetti da LGS o DS. Gli eventi avversi più comunemente riscontrati nei pazienti trattati con il farmaco sono stati sonnolenza, diminuzione dell'appetito, affaticamento, diarrea, innalzamento delle transaminasi, malessere, astenia, eruzioni cutanee, insonnia, disturbi del sonno e infezioni.
Negli USA, Epidiolex verrà commercializzato da Greenwich Biosciences, società controllata dalla stessa GW Pharmaceuticals. In Europa, il farmaco è attualmente in fase di revisione da parte dell'Agenzia Europea per i Medicinali (EMA) per il trattamento delle crisi epilettiche.
Attualmente in Europa l’unico farmaco registrato a base di cannabis è il Sativex, che tra i suoi principi attivi ha anche il CBD. La GW Pharmaceuticals è un’azienda britannica, è non è un caso che proprio la Gran Bretagna sia stata il primo paese a dichiarare il CBD come principio farmacologico, mettendo quindi fine alla produzione ed alla vendita libera. Il ministero della Salute del Regno Unito ha riconosciuto che il CBD è un farmaco e al tempo stesso ne ha vietatoogni forma di “vendita, fornitura, promozione e pubblicità”. Il tutto a partire dal mese di novembre del 2016. Una decisione dovuta al fatto che, essendo ora classificato come farmaco a tutti gli effetti, i produttori di farmaci a base di CBD dovranno ora sottostare alle norme di ricerca e standard che regolano ogni medicinale in vendita.
Nel frattempo all’OMS è iniziata la prima storica revisione delle proprietà terapeutiche della cannabis, che potrebbe avere effetti sui trattati internazionali e sulle tabelle in cui è inserita la cannabis, una decisione che riguarderà anche questo cannabinoide.
Ad oggi in Italia c’era solo un documento del 2008 firmato dall’allora dirigente dell’Ufficio centrale stupefacenti del ministero della Salute, che spiegava come da noi il CBD fosse un componente con riconosciuta attività farmacologica ma che non era inserito in tabella I, quella della sostanze stupefacenti, senza specificare altro.
Come aveva già previsto il farmacista Marco Ternelli, anche in Italia ci sarà probabilmente una regolamentazione. Secondo Ternelli i casi sono due: “Il primo è che qualsiasi prodotto contenente CBD sarà considerato farmaco e quindi dovrà essere autorizzato dall’AIFA (Agenzia Italiana del Farmaco), cosa che però avviene solo per i farmaci industriali”, una decisione che penalizzerebbe fortemente il nascente mercato della cannabis light, che ha bassi valori di THC ma alti di CBD.
Il secondo è “uno scenario meno apocalittico” che prevederebbe il fatto che “in concomitanza all’uscita del suddetto medicinale, venissero regolamentati i dosaggi di CBD, ossia si definisse a quali dosaggi il CBD viene considerato Farmaco (caso sopra) e quando no, permettendo la commercializzazione di CBD come integratore, alimento, etc”.
Redazione di cannabisterapeutica.info